#
Les électrons
#
Un peu d’histoire
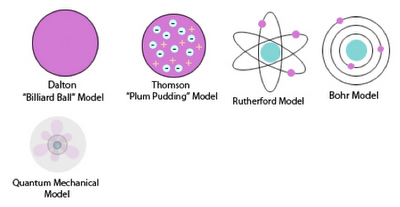
Comme d’habitude, un peu d’histoire. Voici l’évolution du modèle de la structure électronique de l’atome :
J. J. Thompson et son modèle « Pouding » :
Dans ce modèle, l’atome est composé d’électrons (que J.J. Thomson continuait à appeler« corpuscules », bien que George Stoney eut proposé la dénomination d’ électrons en 1894), plongés dans une « soupe » de charges positives pour équilibrer la charge négative des électrons, comme des prunes (plum en anglais) dans un pudding. Les électrons (comme nous les connaissons aujourd’hui) étaient considérés comme dispersés au sein de l’atome, mais avec de multiples structures possibles pour leurs positionnements, comme en particulier des anneaux tournants d’électrons. L’atome était parfois considéré comme ayant un nuage de charge positive plutôt qu’une soupe.
- Earnest Rutherford et son modèle « Planétaire » :
- l’atome est constitué d’un noyau positif autour duquel tournent des électrons négatifs. Entre le noyau - très petit par rapport à l’atome (environ 100 000 fois) - et ses électrons, un très grand vide existe. Ce modèle fut très vite mis en défaut par les équations de Maxwell d’une part, qui prédisent que toute charge accélérée rayonne de l’énergie, et par les expériences montrant la quantification des niveaux d’énergie d’autre part. Problème : c’est un modèle basé sur la mécanique classique, et selon ses calculs les électrons seront captés immédiatement par le noyau, et l’atome n’aura aucune cohésion.
Niels Bohr et son modèle « Bohr-ring » : Le premier modèle « quantique ».
Niels Bohr propose d’ajouter quelques contraintes :
L’électron ne rayonne aucune énergie lorsqu’il se trouve sur une orbite stable (ou orbite stationnaire). Ces orbites stables sont différenciées, quantifiées. Ce sont les seules orbites sur lesquelles l’ électron peut tourner.
L’électron ne rayonne ou n’absorbe de l’énergie que lors d’un changement d’orbite
Pour commodité de lecture, les orbites possibles de l’électron sont représentées dans la littérature comme des cercles de diamètres quantifiés.
Erwin Schrödinger et sa « fonction d’onde(=wave function) » :
Dans ce modèle, les électrons ne sont plus des billes localisées en orbite, mais des nuages de probabilité de présence. Cependant la représentation que l’on pouvait se faire d’un électron — une petite bille ? — était dictée par les formes observées dans le monde macroscopique, transposées sans preuves dans le monde microscopique.

Image simplifiée de l’arrachement d’un électron du nuage électronique dans le modèle de Schrödinger. La notion de « trajectoire » n’est plus valable Ainsi dans ce modèle, contrairement à l’ancien modèle planétaire de l’atome, on ne considère plus que les électrons d’un atome sont en orbite circulaire (ou même elliptique) autour du noyau, mais occupent de manière probabiliste certaines régions de l’espace autour du noyau. Ces régions s’appelle les orbitales atomiques qui occupent différentes couches électroniques autour du noyau. On définit alors comme orbitale atomique une zone de l’espace où la probabilité de trouver un électron autour du noyau est de ≥95 \%. Notre étude concerne ces couches électroniques.
#
Répartition des électrons dans un atome
Définition : Couche électronique
On dit que deux électrons apparitennent à une même couche électronique
Ils se trouvent, en moyenne, à une même distance du noyau
Ou encore, ils sont également liés au noyau.
Pour les éléments avec 1 \leq Z \leq 18 on représente chaque couche électronique par une lettre : K, L, M ; la couche K étant la plus proche du noyau, et ainsi de suite.
Avec une meilleure compréhension de la structure des atomes, grâce à la théorie quantique nous savons maintenant à l’intérieur de ces couche électronique, il y a ce que nous appelons des sous-couches électronique. C’est comme dans chaque niveau énergétique ou se situent les électrons il y a avait des sous-niveaux.
Comme pour les couches électronique il y a nombre maximal d’électron possible dans chaque sous-couche. Les sous-couches s’appellent : s et p (et pour les atomes au-delà de Z=18 il y a aussi une sous-couche d, mais cela ne nous concerne pas). Dans le premier niveau il n’y a qu’une seule sous-couche possible, une sous-couche s. A partir du deuxième niveau il y a d’abord une sous-couche s et puis une sous-couche p. Voici un tableau pour montrer le nombre maximal d’électrons dans chaque niveau énergétique d’un atome :
Remarque :
(En fait chaque sous-couche, s ou p par exemple ne peut contenir que 2 électrons, mais dans chaque niveau énergétique il y un seul type de s et trois types de sous-couches p, d’où le nombre maximal de 2 et 6 respectifs pour les deux types de sous-couches.
En chimie, les électrons les plus importants, ceux qui déterminent la construction des édifices chimiques, sont les électrons périphériques, ou électrons de valence((= valence electrons)), qui appartiennent à la couche externe (appelée souvent la couche de valence((= valence shell)) de l’atome.
#
Les règles de remplissage des couches électroniques
En 1923, Wolfgang Pauli propose un principe (son fameux principe d’exclusion) selon lequel les électrons ne peuvent pas se trouver au même endroit dans le même état quantique((= quantum state)) . Chaque couche (et sous-couche) électronique ne peut contenir qu’un nombre limité d’électrons - comme vu dans la partie précédente. Il y a donc une façon particulière pour remplir les différents niveaux énergétique d’un atome, pour le nombre croissant d’électrons des différents atomes.
Règles de remplissages de couches électroniques
- Il faut toujours commencer par le niveau énergétique le plus bas possible qui a de la place pour accueillir des électrons.
- Les électrons remplissent les couches d’une manière progressive;c’est-à-dire les électrons se placent d’abord dans la couche 1 - K ; puis, lorsque celle-ci est saturée((=saturated)) (atteint le nombre maximal permit) les électrons commence le remplissage de la couche 2 - L, et ainsi de suite.
- A l’intérieur d’une couche, c’est la sous-couche s qui est d’abord rempli avant de commencer à remplir la sous-couche p.
Exemple: Voilà la configuration électronique de quelques atomes :
Hydrogène H (Z=1) : 1s^1
Lithium Li (Z=3) : 1s^22s^1
Carbone C (Z=6) : 1s^22s^22p^2
\triangleright \quad
Configurations électroniques Donner la configuration électronique pour les éléments suivants :
Atome de Soufre (S) Z=16 :
ion de Soufre (S^{-2}) :
Atome de Sodium (Na) Z=11 :
ion de Sodium (Na^+) :
Atome d’Azote (N) Z=7 :
Atome de Chlore (C\ell) Z=17 :
#
Pour ceux qui veulent aller plus loin ...
En fait, d’après la théorie quantique chaque électron dans un atome est caractérisé par 4 nombres quantiques :
Nombre principal n ((= principal quantum number)) : ce nombre correspond au niveau énergétique de l’électron dans l’atome. Les valeurs de n est un entièes et strictement positives, c’est à dire : n = 1, 2, 3, \ldots Un électron au deuxième niveau aurait un nombre n=2.
Nombre azimutal \ell ((= angular quantum number)): ce nombre correspond au sous-couche dans laquelle se trouve l’électron. Les valeur de \ell sont entiers positifs, c’est à dire : \ell = 0, 1, 2, \ldots, n-1. Les sous-couches s, p, \text{et }d correspondent a \ell=0, 1, 2.
Nombre magnétique m_\ell ((= mangetic quantum number)) : ce nombre correspond à "l’orientation" de la sous-couche concercée en trois dimension. Le nombre m_\ell dépend du type de sous-couche, et prend des valeurs entières comprises entre -\ell \ldots \ell. La sous-couche s avec \ell = 0 n’a que m_\ell = 0 possible. La sous-couche p avec \ell = 1 a trois orientations possibles : m_\ell = -1, 0, 1 d’où la limite de 6 électrons max dans une sous-couche p.
Nombre magnétique de Spin m_S ((= spin quantum number)) : correspond au "sens de rotation" de l’électron. Il n’y a que deux possibilités pour le "spin" d’un électrons : m_s = -\dfrac{1}{2}, \dfrac{1}{2}. On peut l’imaginer (par analogie) au sens de rotation d’un tire-bouchon et le sens opposé. Ceci explique aussi la limite de 2 électrons par type de sous-couche.
#
Les électrons et la stabilité dans un atome
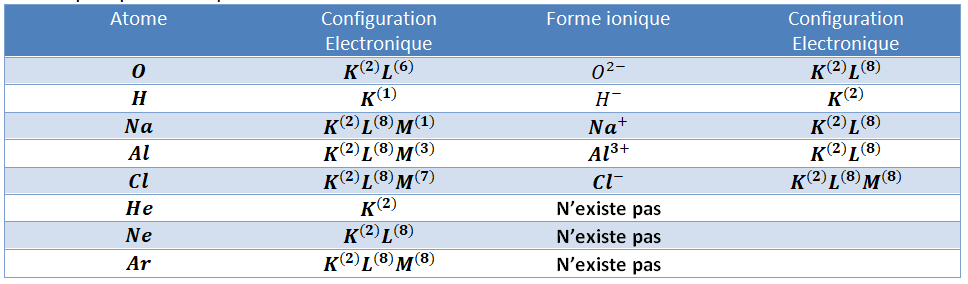
On a déjà rencontré la notion d’ion (en 3^{ème}). Voici un petit résumé :
Les atomes sont, a priori, électriquement neutres, et donc ont le même nombre d’électrons et de protons. Mais ils peuvent perdre ou gagner des électrons, et par conséquent obtenir une charge électrique non-nulle.
La forme chargée d’un atome s’appelle un Ion. Les ions positifs s’appellent cations, et les ions négatifs s’appellent anions.
Un cation est déficitaire en électrons (d’où la charge positive), alors qu’un anion est excédentaire en électrons (d’où la charge négative).
Voici quelques exemples :
\triangleright \quad
Y a-t-il quelque chose en commun
entre les différentes formes ioniques ?
Si l’on considère la configuration électronique, on voit que les formes ioniques ont tous une couche de valence saturée. On dit que c’est la configuration la plus stable.
De plus, on constate que les formes ioniques (stables) correspondent exactement à la configuration électronique de certains éléments (Z=2 ;Z=10 ;Z=18).
En fait, les trois gaz (Hélium, Néon, et Argon) font partie d’une catégorie des éléments qui s’appellent les Gaz Nobles, (ou souvent les Gaz Rares). On dit qu’ils sont chimiquement inertes, ou stable, car ils ne participent que rarement à des réactions chimiques. Ils existent naturellement sous forme d’atomes isolés et on ne les rencontre ni sous la forme d’un ion ni dans des molécules. (Afin de comprendre cette notion de stabilité il faut comprendre que les atomes « cherchent » l’état le plus stable. Une espèce chimique qui est déjà stable, n’a donc pas besoin de participer dans les réactions chimiques). En chimie, le « bonheur » pour un atome est d’avoir la couche externe saturée, et donc la recherche du « bonheur » les amène vers les réactions chimiques qui produisent une configuration électronique comme celle des gaz nobles :
Dans une entité chimique stable, les éléments adoptent la même structure électronique que celle du gaz noble de numéro atomique le plus proche.
Cela explique pourquoi, par exemple la forme ionique d’oxygène est O^{2-}, et non O^{-} : car la première forme donne la même configuration que l’atome de néon (1s^22s^22p^6). A l’exception des gaz nobles, les éléments n’existent pas naturellement sous forme d’atomes isolés, car sous cette forme ils ne sont pas stables.