#
Représentation de Lewis et la liaison covalente
Afin de visualiser la structure électronique de la couche externe d’un atome, le chimiste américain Gilbert N. Lewis développa une schématisation simple :
Les noyaux et les couches internes des atomes sont représentés par les symboles des éléments chimiques correspondants.
Les liaisons covalentes (doublets liants) sont représentées par un trait entre les atomes liés.
Les doublets non-liants sont représentés par des traits autour du symbole.
Il faut satisfaire la règle de l’octet. Or chaque tiret représente deux électrons, donc chaque atome doit être entouré par 4 traits, y compris les doublets liants et non-liants.
Exemple:
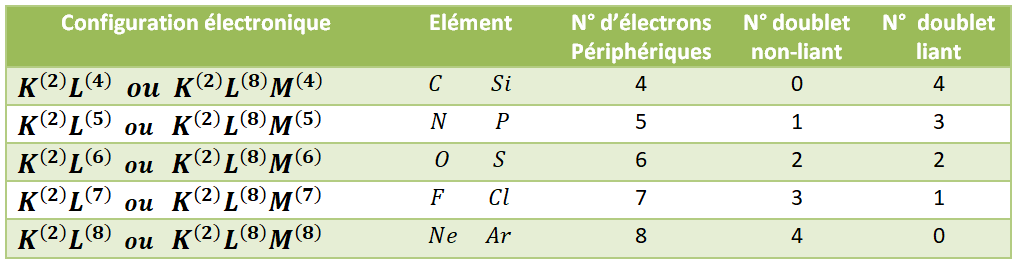
Dans la molécule d’eau, H_2O (figure ci-après), l’oxygène, qui possède 6 électrons périphériques, engage deux électrons dans des liaisons covalentes, un avec chaque atome d’hydrogène. Il lui reste 4 électrons, non engagés dans une liaison, sur sa couche externe. Ils s’associent en deux doublets Non-liants (tirets rouges). Voici l’atome de dioxygène :
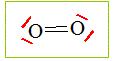
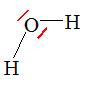
Exemple:
Cyanure d’hydrogène, appelé aussi Acide cyanhydrique (toxique pour l’homme, utilisé dans les pesticides et des fumigateurs).
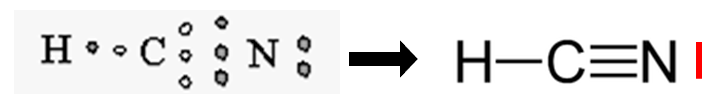
Remarquons le cas du Cyanure d’hydrogène (ainsi que du dioxygène), la présence de plusieurs liaisons entre l’atome de carbone, et l’atome d’azote. Comme expliqué précédemment, chaque trait représente deux électrons partagés, le carbone et l’azote partage donc, au total, 6 électrons. Une liaison covalente multiple est constituée de deux ou trois liaisons covalentes entre deux atomes.
Point méthodologique
Les étapes à suivre pour la construction du diagramme de Lewis :
Déterminer le nombre d’électrons périphérique x de la molécule .
Déterminer le nombre de doublet n : n=\dfrac{x}{2}
Déterminer le nombre de liaisons possible pour chaque atomes.
Repartir les n doublets de manière à ce que chaque atome satisfasse les règles de duet et de l’octet.
Exemple:
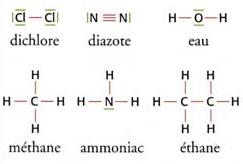
Voici les structures de quelques molécules simples :
dichlore : C\ell_2 ; diazote : N_2 ; eau : H_2O ; méthane :
CH_4 ; ammoniac : NH_3 ; éthane : C_2H_6
\triangleright \quadExercice . Refaire les diagrammes de Lewis a partir des diagrammes avec les points représentants les électrons périphérique.