#
Les molécules
Définition : Molécule
Une molécule est une association stable d’atomes, qui est électriquement neutre. On représente chaque molécule par une formule brute, qui traduit sa composition.
Exemple:
- Acide Sulfurique : H_2SO_4
- Eau : H2O
- Carbon dioxide : CO2
Si la possibilité de simplement gagner ou perdre des électrons n’existe pas (pour former des ions), alors, les atomes vont essayer de partager des électrons entre d’eux, afin de trouver une configuration électronique stable. Ce mis-en-commun des électrons s’appelle une liaison chimique, ou plus précisément une liaison covalente.
#
Liaisons covalentes
Définition : Liaison covalente
Une liaison covalente entre deux atomes correspond à la mise en commun de deux électrons périphériques. En formant des liaisons covalentes, chaque atome s’entoure des électrons requis pour respecter la règle de l’octet (ou du duet pour l’hydrogène et le lithium). Dans les molécules donc, les atomes sont plus stables que s’ils étaient isolés.
La liaison formée entre deux atomes (i.e. les deux électrons partagés par les atomes) s’appelle un doublet liant. Le doublet liant est considéré comme appartenant entièrement à chacun des deux atomes liés.
Les électrons périphériques qui ne sont pas engagés dans une liaison covalente s’associent deux par deux pour former des doublets non-liants, autour de l’atome.
Définition : Energie de liaison
L’énergie de liaison est la quantité d’énergie nécessaire pour briser une liaison covalente.
Elle s’exprime comme la quantité d’énergie (en Joules) nécessaire pour briser une mole de molécule en atomes qui la constituent.
Il s’agit d’une mesure de la force d’une liaison, plus la liaison est forte, plus il faut de l’énergie pour la briser.
Remarque.
Cette énergie de liaison est, en effet, l’énergie qui est libérée quand on transforme des molécules, notamment dans les réaction exothermique, et les réactions ou une macromolécules est transformée en des molécules plus petites.
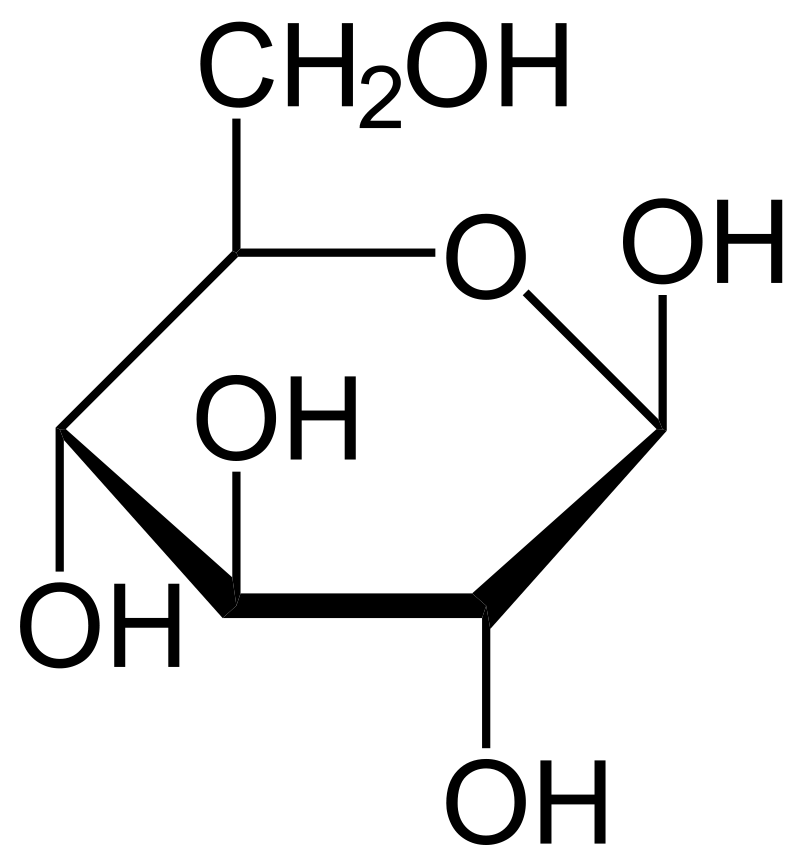
Une exemple très parlant de ca est le métabolisme. Nous vivons de l’énergie du métabolisme des molécules comme le glucose. Cette molécule a une formule brute de C_6H_{12}O_6 Lors des différentes étapes de la digestion de cette molécules les différentes liaisons entre les carbones, entre carbone et hydrogène et entre carbone et carbone et oxygène sont brisées et leurs énergie libérée. Le produit de cette transformation est des molécules d’eau et de dioxyde de carbone .
Il est intéressant de noter que ce processus et l’exacte inverse de la photosynthèse, pendant lequel les molécules d’eau et de dioxyde de carbone sont rassembler afin de former des molécules de glucose. La formation des liaisons de la molécule de glucose nécessite de l’énergie, cette énergie provenant de la lumière du soleil, captée et utilise par les molécule de chlorophyll.
L’énergie qui vous permet de rester vivant est litéralement l’énergie du soleil!
En connaissant maintenant la nature des liaisons covalentes, peut-on déterminer le nombre de liaison covalente nécessaire pour chaque atome ? La réponse est oui!
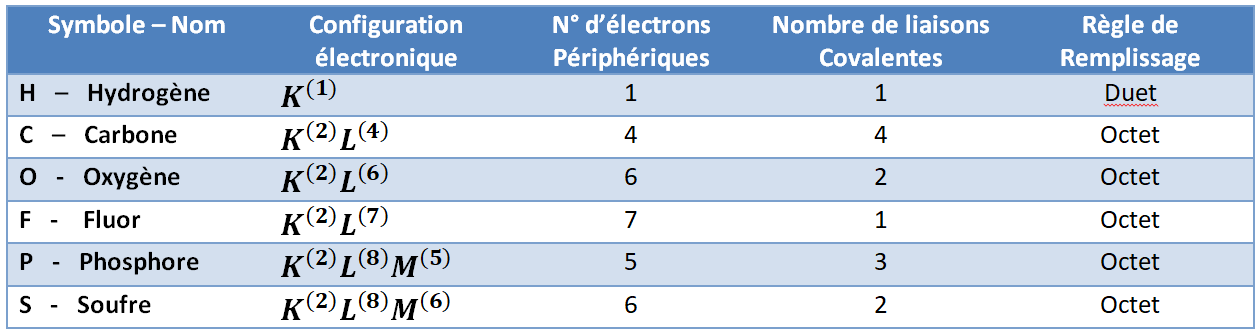
Pour un élément le nombre de liaisons covalentes à former est égal au nombre d’électrons manquants sur la couche externe de l’atome isolé pour obéir aux règles du duet et de l’octet.
Considérons les cas suivants :
l’élément N (azote) avec Z=7. Cet élément a une configuration électronique de K^{(2)}L^{(5)}. Pour obéir la règle de l’octet, il lui manque 3 électrons. L’azote forme donc 3 liaisons covalentes.
l’élément Cl (chlore) avec Z=17. Cet élément a une configuration électronique de K^{(2)}L^{(8)}M^{(7)}. Pour obéir la règle de l’octet, il lui manque 1 électrons. L’azote forme donc 1 liaison covalente.
Voici un tableau de quelques éléments et le nombre de liaisons covalentes :