#
Dilutions
Assez souvent on a besoin de changer la concentration d’une solution afin d’avoir les réactifs dans les bonnes proportions. Afin d’y arriver on a donc besoin d’effectuer une dilution.
Définition : Dilution
Diluer une solution, c’est, en ajoutant du solvant, constituer une nouvelle solution moins concentrée que la solution initiale.
La solution initiale s’appelle la solution mère, et la solution diluée s’appelle la solution fille.
La solution fille a toujours une concentration inférieure à celle de la solution mère.
Considérons la situation suivante : On dispose d’un volume V d’une solution A, de concentration molaire en soluté C. Nous allons diluer cette solution en ajoutant du solvant. La solution A est la solution mère. La solution B, obtenue après dilution est la solution fille. Elle a une concentration molaire C' et son volume est V'.
Lors de la dilution, le volume augmente, mais la quantité de matière de soluté n est toujours la même. On peut donc écrire :
C=\dfrac{n}{V} \text{ et } C'=\dfrac{n}{V'} \quad (1)Or nous avons V<V' et donc \dfrac{1}{V}>\dfrac{1}{V'} \Longleftrightarrow C>C'. On voit donc qu’une dilution donne une diminution de la concentration de la solution mère.
Revenons alors à l’équation (1) :
\begin{aligned}
C=\dfrac{n}{V} &\Longrightarrow n=C\cdot V \\
C'=\dfrac{n}{V'} &\Longrightarrow n=C'\cdot V'
\end{aligned}Dans une dilution, la quantité de matière ne change pas. Si l’on appelle C et V la concentration molaire et le volume de la solution mère, et C' et V' la concentration molaire et le volume de la solution fille, on arrive à la relation suivante :
C\cdot V = C'\cdot V' (2)
#
Préparation d’une solution par dilution
Souvent on prépare une solution d’une concentration donnée C' en diluant une solution concentrée d’une concentration connue C. Cette opération n’est possible que si C'<C.
On commence en écrivant C\cdot V=C'\cdot V'.
Connaissant la concentration C, la valeur de la concentration désirée C' et celle du volume désiré V', on en déduit la valeur du volume V :
V = \dfrac{C'\cdot V'}{V}On prélève un volume V de la solution mère. On ajoute alors un volume v = V' - V de solvant (presque toujours de l’eau distillée), de façon à obtenir un V'.
Voici la réalisation pratique d’une dilution :
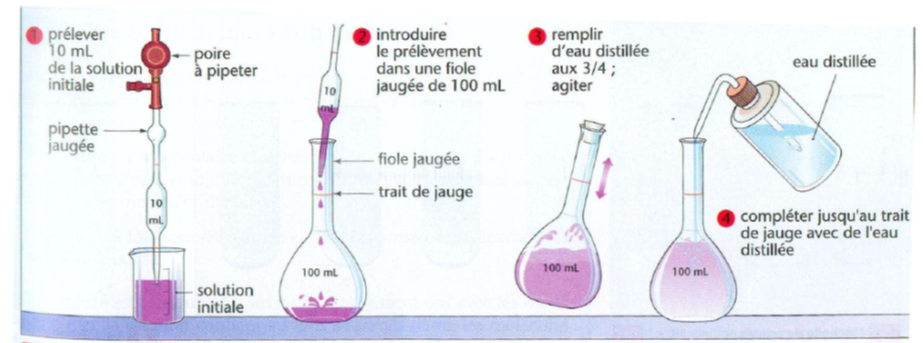
$\triangleright On dispose d’une solution de sulfate de cuivre, de concentration C=1,00\cdot 10^{-2}\; mol\cdot L^{-1}. On souhaite obtenir un volume V'=100 \; mL d’une solution fille de concentration C' qui est \frac{1}{100} de la concentration mère.
Quel est le volume de solution mère à prélever ?
Donner le mode opératoire.


